Grafit, formulă moleculară: C, greutate moleculară: 12,01, este o formă de element carbon, fiecare atom de carbon este conectat prin alți trei atomi de carbon (aranjați în hexagoane de tip fagure) pentru a forma o moleculă covalentă. Pentru că fiecare atom de carbon emite un electron, cei care se pot mișca liber, deci grafitul este un conductor.
Grafitul este unul dintre cele mai moi minerale, iar utilizările sale includ realizarea de mine de creion și lubrifianți. Carbonul este un element nemetalic situat în grupa IVA al doilea ciclu al tabelului periodic. Grafitul se formează la temperaturi ridicate.
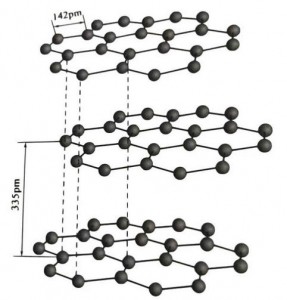
Grafitul este un mineral cristalin de elemente de carbon, iar rețeaua sa cristalină este o structură stratificată hexagonală. Distanța dintre fiecare strat de plasă este de 3,35 A, iar distanța dintre atomii de carbon din același strat de plasă este de 1,42 A. Este un sistem de cristal hexagonal cu un clivaj complet stratificat. Suprafața de clivaj este în principal legături moleculare, mai puțin atractive pentru molecule, astfel încât flotarea sa naturală este foarte bună.
În cristalele de grafit, atomii de carbon din același strat formează o legătură covalentă cu hibridizarea sp2, iar fiecare atom de carbon este conectat la alți trei atomi în trei legături covalente. Cei șase atomi de carbon formează un inel cu șase continue în același plan, extinzându-se într-o structură lamelă, unde lungimea legăturii legăturii CC este de 142 pm, care se află exact în intervalul de lungime a legăturii cristalului atomic, deci pentru același strat , este un cristal atomic. Atomii de carbon din același plan au o orbită p, care se suprapun. Electronii sunt relativ liberi, echivalent cu electronii liberi din metale, astfel încât grafitul poate conduce căldura și electricitatea, ceea ce este caracteristica cristalelor metalice. Astfel clasificate și ca cristale metalice.
Stratul mijlociu de cristal de grafit este separat de 335pm, iar distanța este mare. Este combinat cu forța van der Waals, adică stratul aparține cristalului molecular. Cu toate acestea, deoarece legarea atomilor de carbon din același strat plan este foarte puternică și extrem de greu de distrus, punctul de dizolvare al grafitului este, de asemenea, foarte ridicat și proprietățile sale chimice sunt stabile.
Având în vedere modul său special de lipire, nu poate fi considerat ca un singur cristal sau policristal, grafitul este acum în general privit ca un cristal mixt.
Ora postării: 31-iul-2023